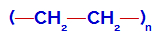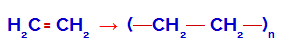Estratégias práticas para o ensino de polímerosAntes de conhecer as estratégias práticas para o ensino de polímeros que este texto propõe, é importante relembrar alguns princípios básicos sobre essa importante classe de materiais para o ser humano. Os polímeros são macromoléculas formadas a partir da união de vários monômeros. Veja um exemplo de fórmula estrutural do polímero polietileno:
Como é possível perceber, a fórmula estrutural do polietileno apresenta a união de monômeros de etileno. Para isso, a ligação pi existente no monômero etileno foi rompida, como na demonstração a seguir:
De uma forma geral, os polímeros são classificados em naturais e sintéticos. Veja exemplos: a) Naturais: b) Sintéticos
Estratégias práticas para o ensino de Polímeros O objetivo deste texto é propor ao educador algumas estratégias práticas para o ensino de polímeros para que o estudante seja capaz de compreender de forma prática as características desses materiais. Neste texto, propomos a identificação de um polímero natural e a utilização de um polímero sintético para produzir uma “geleca”. Educador, antes de iniciar a atividade prática, é fundamental trabalhar os conceitos de polímeros sintéticos e naturais com os estudantes. 1) Identificação de um polímero natural O polímero natural a ser identificado é o carboidrato amido, o qual é formado por monossacarídeos chamados de glicose. Para realizar a identificação, vamos utilizar os seguintes materiais:
Para realizar o experimento, basta seguir o procedimento:
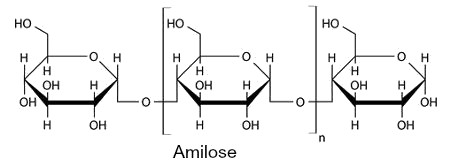
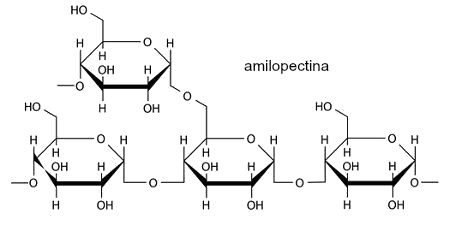
A explicação sobre o experimento é um pouco complexa, mas muito importante. O amido é formado por dois polímeros diferentes, a amilose e a amilopectina. Ambas sofrem uma reação de complexação com o iodo, o que resulta na mudança de coloração:
Assim, quando gotejamos iodo sobre um alimento e a cor resultante é roxa, isso indica a presença da mistura amilose e amilopectina, já que a combinação das cores azul e vermelho resulta na cor roxa. 2) Produção de geleca a partir de um polímero sintético O polímero sintético a ser utilizado é um plástico (PVA) denominado de acetato de polivinila. Ele é muito utilizado na produção de colas brancas e isopor. Para desenvolver a “geleca”, os materiais necessários são:
O procedimento a ser seguido para a produção do plástico é bem simples:
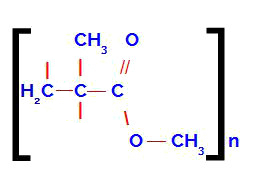
Conclusão e explicação Quando misturamos bicarbonato de sódio com a água boricada, ocorre a seguinte reação química: H3BO3 + NaHCO3 → Na3BO3 + H2CO3 Na reação, foram formados borato de sódio (Na3BO3) e o ácido carbônico, que é instável e decompõe-se em água e CO2. Por isso, vemos a formação de bolhas na água do béquer. A presença do borato de sódio é fundamental porque ele reagirá com a cola de isopor, que apresenta o polímero acetato de polivinila, cuja estrutura é:
Quando o borato de sódio está presente na mesma solução que o acetato de polivinila, são originadas cadeias tridimensionais que interagem com as moléculas de água e resultam em um gel. Nesse gel, temos um cruzamento entre as cadeias do polímero acetato de polivinila. O borato de sódio dá origem a pontes que unem as cadeias do acetato de polivinila, formando uma rede entre elas, o que resulta em um material extremamente viscoso e distensível. Quanto maior a quantidade de borato, mais redes formam-se e a estrutura passa a se tornar cada vez mais rígida.
|